Özelliklerine göre düzenlenmiş kimyasal elementlerin tablosu. Periyodik tablo (cetvel) nedir? İsimleri Nelerdir? Elementlerin Tarihçesi.
Bu, bilinen tüm kimyasal elementleri gösteren bir tablodur. Tablo yüzden fazla kareden oluşuyor. Her kare bir elementi temsil eder. Bir kare, öğenin adını temsil eden bir veya iki harf ve o öğenin özelliklerini anlatan sayılar içerir.
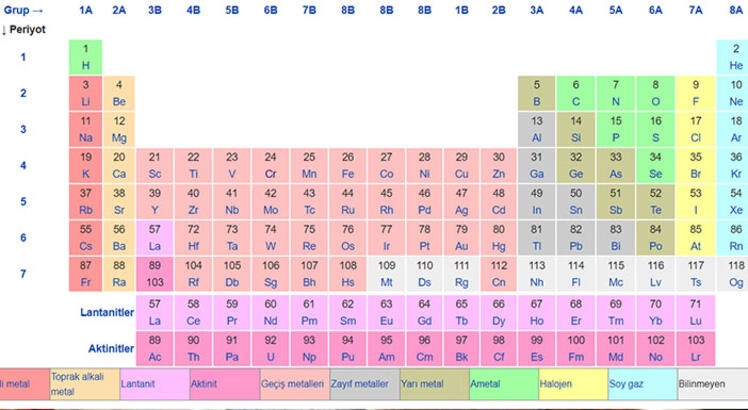
Tablodaki her karenin konumu, her bir öğe hakkında birçok şey anlatır. İlk olarak, elementler atom numarasına veya sahip oldukları proton sayısına göre düzenlenir. Grafiğin üstündekiler en az protona sahiptir. Bir elementin yeri aynı zamanda tepki verme olasılığını da gösterir. Ayrıca elektronlarının nasıl düzenlendiğini de gösterir.
1800’lerin ortalarında, birçok kimyager, elementlerin nasıl etkileşime girdiğini açıklayan kalıplar aradı. O zamanlar bilim adamları atomları oluşturan protonları, nötronları ve elektronları bilmiyorlardı. Ancak elementlerin farklı atom ağırlıklarına sahip olduğunu anladılar. Atom ağırlığı, bir elementin bir atomunun ortalama ağırlığıdır.
1869’da Rus kimyager Dimitri Mendeleev bilinen 63 elementi atom ağırlıklarına göre sıraladı. Belirli aralıklarla veya periyotlarda değişen elementlerin özelliklerindeki eğilimleri gördü. Diğer bilim adamları kendi periyodik tabloları üzerinde çalışıyorlardı, ancak önce Mendeleev tablosunu yayınladı.
Bilim adamları daha fazla element keşfettikçe periyodik tablo büyümeye devam etti. Bunlar, 1890’da tanımlanan soy gazları içerir. Bu, helyum gibi diğer elementlerle reaksiyona girmekten hoşlanmayan bir grup elementtir. 1940’lardan başlayarak, bilim adamları atomları veya atom parçalarını çarpıştırarak birçok yeni element buldular.
2018’in sonunda kimyacılar daha önce hiç gözlemlenmemiş dört elementi doğruladılar . Böylece bilinen element sayısı 118’e ulaştı ve tablonun 7. sırasını tamamladı.
- 2021 yılı, ilk olarak 1869’da tasarlanan periyodik tablonun 152. yıldönümüdür.
Periyodik Tablo Özellikleri
Bir periyotta soldan sağa doğru gidildikçe,
Proton, nötron sayıları ve kütle numarası artar.
Atom numarası artar.
Değerlik elektron sayısı artar.
Elektron alma isteği (ametalik özellik) artar.
Yörünge sayısı değişmez.
Atom hacmi ve çapı azalır.
Bir grupta yukarıdan aşağıya inildikçe,
Proton, nötron sayıları ve kütle numarası artar.
Atom numarası artar.
Değerlik elektron sayısı değişmez (Bu nedenle aynı gruptaki elementlerin kimyasal özellikleri benzerdir).
Elektron verme isteği (metalik karakter) artar.
Yörünge sayısı artar.
Atom hacmi ve çapı artar.
Kaynak: https://www.sciencenewsforstudents.org/article/scientists-say-periodic-table
