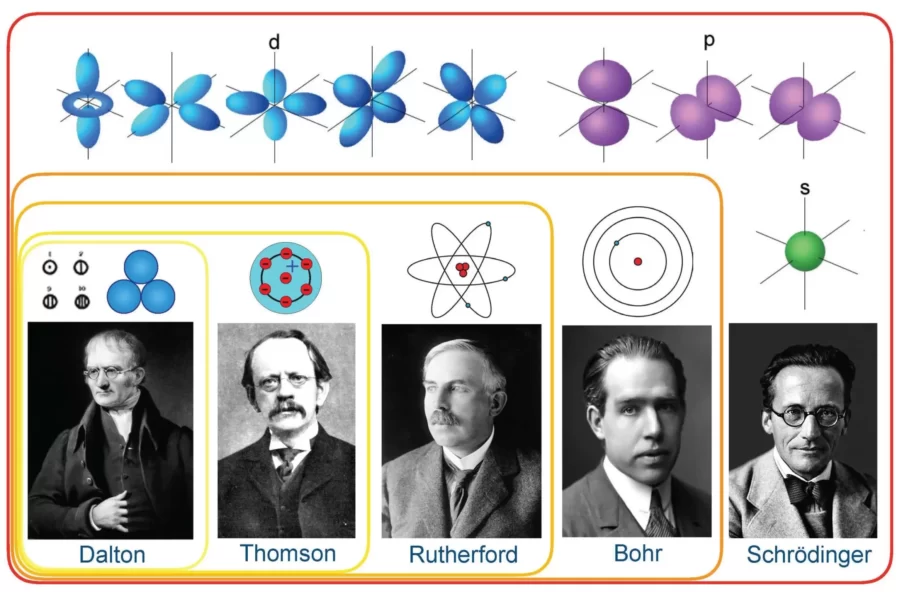
Antik Yunan felsefesi döneminden modern kuantum mekaniğine kadar atom teorisi, her biri kendi dönemi için oldukça devrim niteliğinde olan birçok gelişmişliğe sahip.
Etrafımızdaki şeylerin doğasına ilişkin anlayışımız sürekli olarak değişim halindedir. Şu anda oldukça açık görünen şeyler önümüzdeki yıllarda geçerliliğini yitirebilir. Bilimin zaman içinde kendini geliştirmesinin en mükemmel örneği atom teorisinin evrimi olmuştur.
Bilimin kanıta dayalı olmadığı, daha çok bir felsefe biçimine benzediği eski günlerden başlayalım; insanlar her şeyin yalnızca dört elementten oluştuğuna inanıyordu: su, ateş, toprak ve hava. O zamanlar kimyanın ne kadar kolay olabileceğini hayal edin!
Demokritos’un Atom Fikri
MÖ 400 civarında Demokritos adlı Yunan filozofu, dünyadaki her şeyin “bölünemez” anlamına gelen “atomos” adı verilen, yok edilemeyen çok küçük parçacıklardan oluştuğu teorisini ortaya attı. Maddelerin özelliklerinin, yapıldıkları atomların türüne bağlı olduğuna inanıyordu. Örneğin ekşi veya keskin tadı olan şeyler sivri kenarlı parçacıklardan, tatlı şeyler daha yuvarlak ve pürüzsüz atomlardan, metaller ise sert atomlardan yapılıyordu. Şeklin bu şekilde yanlış yorumlanmasının dışında Demokritos, bir maddenin özelliğini belirleyen atom bileşimi konusunda oldukça doğru yoldaydı.
Ancak bu teori, gezegendeki her şeyin dört elementten oluştuğuna inanan özgün sosyal etki sahibi Aristoteles tarafından büyük ölçüde itibarsızlaştırıldı.
Dalton’un Atom Teorisi
Sürekli değişen atom teorisinin bir sonraki durağı, neredeyse 2000 yıl sonra, John Dalton adlı İngiliz kimyager ve meteoroloji meraklısından geldi. İki gazı karıştırıp davranışlarını gözlemlediği deneyler yaptı. Test ettiği gazların çoğu, diğerinin varlığından rahatsız olmadan bağımsız olarak mevcuttu. Ancak nitrik oksidin atmosferik oksijenle etkileşime girmesine izin verildiğinde farklı bir şey buldu. 36 ölçü saf nitro gazı, 100 ölçü hava ile reaksiyona girerek 80 ölçü ne nitro ne de oksijen içeren yeni bir gaz oluşturdu.
Bu onun merakını uyandırdı ve aynı deneyi farklı hacimlerdeki gazlarla gerçekleştirdi. Gazların birbirleriyle yalnızca sabit bir oranda reaksiyona girdiğini gözlemledi, bu da katlı oranlar yasasının ve atomcu teorisinin ortaya çıkmasına neden oldu.
Dalton, bu dünyadaki her şeyin atomlardan, her element için benzersiz olan, yok edilemeyen küçük katı kürelerden oluştuğunu teorileştirdi. Farklı elementlerin atomları birleşerek farklı bileşikler oluşturur ve kimyasal reaksiyonlar sırasında yeniden düzenlenir. 200 yıl sonra bile bu kavramın bir kısmı geçerliliğini koruyor.
Thompson Atom Modeli (Üzümlü Kek Modeli)
19.yüzyılın sonlarına kadar atomlar bölünemez parçacıklar olarak resmediliyordu; Bu düşünceyi kıran ilk kişi İngiliz fizikçi JJ Thompson ve onun güvenilir katot ışını tüpü oldu. Bir cam tüp vakumunun içinde, metal elektrotlara yüksek voltaj uygulanarak görünür bir parçacık ışını veya katot ışınları üretildi. Metalden üretilen parçacıkların akışı negatif yükten saparak pozitif yüke doğru yöneldi.
İlginizi çekecek bir yazı: Nöron nedir? Yapısı ve özellikleri
Bu deneyi diğer metallerle birkaç kez tekrarladıktan sonra ilk atom modelini ortaya çıkardı. Ünlü üzümlü kek modeli, atomu pozitif yüklü bir kütleden (kek) oluşan ve içinde küçük negatif yüklerin (üzüm gibi) gömülü olduğu bir parçacık olarak tanımladı.
Rutherford’un Atom Modeli
Başlangıçtaki bazı dirençlerden sonra bu model bilim dünyasında oldukça popüler hale geldi, ancak Yeni Zelanda doğumlu Ernest Rutherford ikna olmamıştı. 1900’lerin başlarında radyoaktivite çok popülerdi ve Rutherford, radyoaktif bozunma üzerine yaptığı çalışmalar sırasında alfa, beta ve gama ışınlarını keşfetti. Alfa parçacıkları üretmek ve bunu bir atomun yapısını araştırmak için kullanmak için bir yöntem geliştirmek istiyordu.
O dönemde her fizikçinin yaptığını yaptı; bir deney ortaya attı. Geiger-Marsden deneyi olarak da bilinen altın levha deneyi, arkasında bir alfa parçacığı çarptığında parıldayan dairesel bir Çinko Sülfür kaplı ekran bulunan ince bir altın levha tabakasından oluşuyordu. Rutherford parçacıkların folyoyu delerek arkasındaki ekrana çarpmasını bekliyordu. Parçacıkların çoğu beklendiği gibi davranırken bazıları 90 dereceden daha büyük bir açıyla saptı.
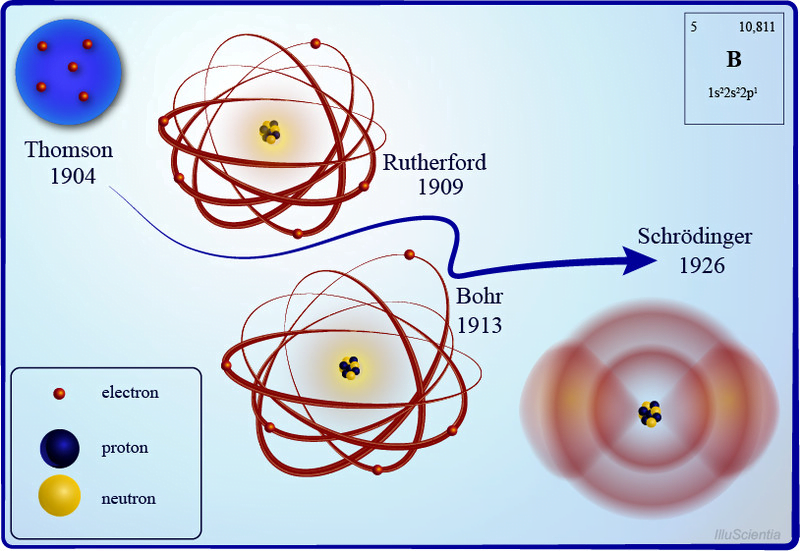
Gözlemlerine dayanarak öncekini çürüten yeni bir atom modeli ortaya çıkardı. Atom kütlesinin çoğunun pozitif yüklü bir merkezde yoğunlaştığı (daha sonra bu merkeze Latince “fındık” anlamına gelen çekirdeğe adını verdiği), çevresinde elektronların güneşin etrafındaki gezegenler gibi yörüngede döndüğü bir atom yapısı önerdi.
Bohr’un Atom Modeli
Rutherford’un atom teorisinin yayınlanmasından bir yıl sonra Niels Bohr modelde bir tutarsızlık buldu. Eğer elektronlar pozitif yüklü bir merkezin etrafında dönerse, bir noktada bu elektronlar enerjilerini kaybedecek ve çekirdeğe çökecek, bu da atomları kararsız hale getirecektir. Ancak çoğu atomun (radyoaktif olanlar dışında) oldukça kararlı olduğu kanıtlandığından durum böyle değildi.
Kuantum fiziğinin devreye girdiği yer burasıdır . Bohr, elektronların çekirdeğin etrafında sabit yörüngeler veya kabuklar halinde hareket ettiğini öne sürmek için kuantize edilmiş enerji kavramını kullandı. Çekirdeğe daha yakın olan kabukların enerjisi daha düşük, en uzaktaki ise en yüksek enerjiye sahiptir. Eğer bir elektron daha düşük enerjili bir yörüngeye sıçrarsa, fazladan enerjiyi radyasyon biçiminde yayar ve böylece atomik kararlılık korunur.
Şu makaleyi de okuyabilirsiniz: Karanlık madde nedir?
Bohr’un modeli karmaşık çok elektronlu sistemler için geçerli olmasa da, bu model hala çoğu ders kitabında atomik yapının en popüler temsilidir.
Schrödinger Atom Modeli
Ne kadar denersek deneyelim, kuantum mekaniğinin karmaşıklıklarından kaçamayız. Elektronlar gibi varlıkların kuantum davranışlarının belirlenmesiyle Bohr’un atom modelinin Heisenberg’in Belirsizlik ilkesini karşılamadığı oldukça açık hale geldi. Belirsizlik ilkesine göre, bir atomdaki elektronların kesin konumunu ve yörüngesini bilmek imkansızdır, bu da Bohr’un varsaydığı gibi elektronların sabit yörüngelerde var olamayacakları anlamına geliyor.
Dalga-parçacık ikiliği kavramını belirsizlik ilkesiyle birleştiren Erwin Schrödinger, atomun kuantum mekaniksel modelini ortaya çıkardı. Bu modelde elektronlar çekirdeğin etrafında dairesel yörüngelerde değil, atomun içinde elektron bulma olasılığının en yüksek olduğu bölge olan atomik yörüngedeki elektron bulutları şeklinde dönüyor. Ayrıca bir atomdaki elektron seviyelerinin enerjisini doğru bir şekilde hesaplamamıza yardımcı olacak Schrödinger dalga denklemlerini de formüle etti. Bu yeni ve geliştirilmiş atom modeli bize bir elektronun nerede olduğunu değil, nerede olabileceğini söylüyor.
İnsanlık her zaman büyük sorularla boğuşmuştur: Etrafımızdaki dünyayı neler oluşturuyor? Peki neden farklı maddeler farklı davranıyor?
Atom teorisinin evrimindeki her adım, canlı dünyamızı yöneten atom altı parçacıkların sırlarını anlamaya bizi biraz daha yaklaştırdı. Ama yine de her zaman öğrenilecek daha çok şey olduğunu unutmayalım!
Referanslar:
- History of Chemistry – www.brooklyn.cuny.edu
- Usselman, M. C., Leaist, D. G., & Watson, K. D. (2008, January 11). Dalton’s Disputed Nitric Oxide Experiments and the Origins of his Atomic Theory. ChemPhysChem. Wiley.
- Evolution of Atomic Theory – Chemistry – UH Pressbooks. The University of Hawaiʻi System
- Rutherford and Bohr describe atomic structure – PBS. The Public Broadcasting Service
- Niels Bohr – Facts – NobelPrize.org. The Nobel Prize
- Alpha Particles and the Atom – Niels Bohr Library & Archives. The American Institute of Physics
- The Gold Foil Experiment (Ernest Rutherford). Purdue University
- No. 2237: Modeling the Atom – University of Houston. The University of Houston